Son aquellas que ocurren entre las moléculas distintas. las fuerzas intermoleculares son más débiles, sin embargo la suma de todas impacta significativamente sobre las propiedades de los materiales que los constituyen.
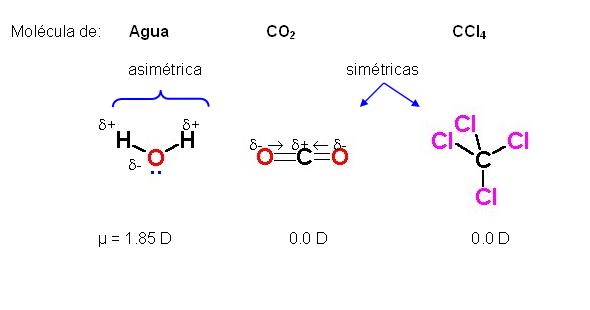
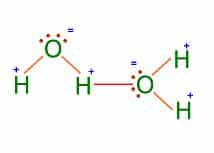
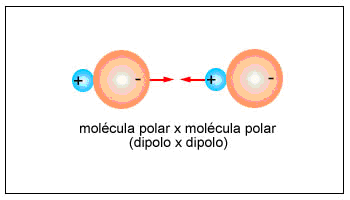 Dipolo-dipolo: Una molécula es un dipolo cuando existe una distribución asimétrica de los electrones debido a que la molécula está formada por átomos de distinta electronegatividad. Como consecuencia de ello, los electrones se encuentran preferentemente en las proximidades del átomo más electronegativo. Se crean así dos regiones (o polos) en la molécula, una con carga parcial negativa y otra con carga parcial positiva.
Dipolo-dipolo: Una molécula es un dipolo cuando existe una distribución asimétrica de los electrones debido a que la molécula está formada por átomos de distinta electronegatividad. Como consecuencia de ello, los electrones se encuentran preferentemente en las proximidades del átomo más electronegativo. Se crean así dos regiones (o polos) en la molécula, una con carga parcial negativa y otra con carga parcial positiva.
Cuando dos moléculas polares (dipolos) se aproximan, se produce una atracción entre el polo positivo
de una de ellas y el negativo de la otra. Esta fuerza de atracción entre dos dipolos es tanto más intensa cuanto mayor es la polarización de dichas moléculas polares o, dicho de otra forma, cuanto mayor sea la diferencia de electronegatividad entre los átomos enlazados.
Ión-ión: Son las que se establecen entre iones de igual o distinta carga:
- Los iones con cargas de signo opuesto se atraen
- Los iones con cargas del mismo signo se repelen
La magnitud de la fuerza electrostática viene definida por la ley de Coulomb y es directamente proporcional a la magnitud de las cargas e inversamente proporcional al cuadrado de la distancia que las separa.
Ión-dipolo inducido: Tienen lugar entre un ión y una molécula apolar. La proximidad del ión provoca una distorsión en la nube electrónica de la molécula apolar que convierte (de modo transitorio) en una molécula polarizada. En este momento se produce una atracción entre el ión y la molécula polarizada.
Interacciones hidrofóbicas:
Comentarios
Publicar un comentario