Enlaces químicos

https://es.wikipedia.org/wiki/Enlace_qu%C3%ADmico
Enlace iónico
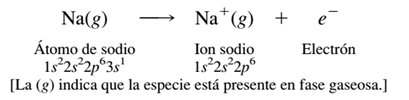

 Debido a que las cargas positivas y negativas se separan en el enlace, las moléculas con enlaces covalentes polares interactúan con dipolos en otras moléculas.
Debido a que las cargas positivas y negativas se separan en el enlace, las moléculas con enlaces covalentes polares interactúan con dipolos en otras moléculas.
COVALENTE NO POLAR
Un enlace químico es la interacción física responsable de las fusiones entre átomos, moléculas e iones, que tiene una estabilidad en los compuestos diatónicos y poli atómicos, que conectan entre sí para dar más electrones.
Las moléculas, (que forman la mayor parte del ambiente físico que nos rodea) está unido por enlaces químicos, que determinan las propiedades físicas y químicas de la materia. Las cargas opuestas se atraen porque al estar unidas adquieren una situación más estable que cuando estaban separadas. Esta situación de mayor estabilidad suele darse cuando el número de electrones que poseen los átomos en su último nivel es igual a ocho, estructura que coincide con la de los gases nobles ya que los electrones que orbitan el núcleo están cargados negativamente, y que los protones en el núcleo lo están positivamente, la configuración más estable del núcleo y los electrones es una en la que los electrones pasan la mayor parte del tiempo entre los núcleos, que en otro lugar del espacio.
https://es.wikipedia.org/wiki/Enlace_qu%C3%ADmico
Enlace iónico
Es una unión de partículas que resulta de la presencia de atracción electrostática entre los iones de distinto signo, es decir, uno fuertemente electropositivo (baja energía de ionización) y otro fuertemente electronegativo (alta afinidad electrónica). Eso se da cuando en el enlace, uno de los átomos capta electrones del otro.
Cuando una sustancia contiene átomos de metales y no metales, los electrones son atraídos con más fuerza por los no metales, elementos de elevadas electronegatividades y afinidad electrónica, los cuales se transforman en iones con carga negativa; los metales, con energía de ionización pequeña, a su vez, se convierten en iones con carga positiva.
Los iones de cargas diferentes se atraen electrostáticamente formando enlaces iónicos.
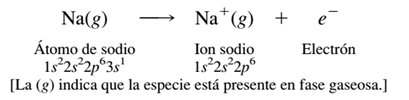
https://www.ecured.cu/Enlace_i%C3%B3nico
Enlace covalente
Es la fuerza electromagnética que mantiene unidos a átomos que comparten electrones, los cuales tienen espines o giros opuestos. Los átomos enlazados se encuentran neutros y generalmente son no metálicos.

Propiedades de los Enlaces Covalentes:
- A temperatura ambiental pueden ser sólidos, líquidos o gaseosos.
- Algunos pueden ser sólidos cristalinos
- Generalmente tienen baja temperatura de fusión y ebullición.
- Generalmente son insolubles en agua, pero si son solubles en solventes apolares
- Son aislantes, es decir, son malos conductores eléctricos.
http://www.fullquimica.com/2011/04/enlace-covalente.html
COVALENTE POLAR
Un enlace covalente polar es un enlace covalente entre dos átomos donde los electrones que forman el enlace están desigualmente distribuidos.
Esto provoca que la molécula tenga un ligero momento dipolar eléctrico en el que un extremo es ligeramente positivo y el otro ligeramente negativo.
La carga de los dipolos eléctricos es menor que una carga unitaria completa, por lo que se consideran cargas parciales y se denotan por delta más (δ+) y delta menos (δ-) (Boundless, 2016).
 Debido a que las cargas positivas y negativas se separan en el enlace, las moléculas con enlaces covalentes polares interactúan con dipolos en otras moléculas.
Debido a que las cargas positivas y negativas se separan en el enlace, las moléculas con enlaces covalentes polares interactúan con dipolos en otras moléculas.
Esto produce fuerzas intermoleculares tipo dipolo-dipolo entre las ellas (Helmenstine, Polar Bond Definition and Examples, 2017).
https://www.lifeder.com/enlace-covalente-polar/
COVALENTE NO POLAR
Es cuando se comparten electrones sin que haya prácticamente ninguna de formación de los orbitales. Se establece cuando la diferencia E.N es menor a 0.5 y son los enlaces mas fuertes que existen un compuesto con covalente perfecta y 100 % simétrico genera características como por ejemplo la dureza y estabilidad del diamante.
Algunas de las propiedades que dependen el grado de covalencia son:
La estabilidad y falto reactividad de compuesto
Menor solubilidad en agua y otros solventes polares no polares
Menor conductividad termina y eléctrica
Autor: Jaime Leobardo Castañeda Hidalgo

Comentarios
Publicar un comentario